美国食品和药物管理局(FDA)疫苗和相关生物产品咨询委员会(VRBPAC)以21:0、一票弃权的投票结果建议FDA为Novavax新冠疫苗(NVX-CoV2373)授予紧急使用权(EUA),用于18岁及以上年龄的个人。
VRBPAC考察了来自关键性3期临床试验PREVENT-19的数据,该临床试验在美国和墨西哥招募了近3万名年龄在18岁及以上的参与者,并且试验结果发布在了《新英格兰医学杂志》上。在该试验中,Novavax新冠疫苗显示出90.4%的有效性(95%可信区间[CI],82.9至94.6;P<0.001),具有令人放心的安全性。严重和重度不良事件的数量较少,疫苗组和安慰剂组之间保持平衡。试验期间观察到的最常见不良反应(极常见≥1/10)包括头痛、恶心或呕吐、肌痛、关节痛、注射部位压痛/疼痛、疲劳和乏力。

数据显示,总的来说,心肌炎的发生率在疫苗组和安慰剂组之间保持平衡(0.007%和0.005%),在Novavax试验的交叉后部分,观察到的病例都在预期发生率内。
FDA在决定EUA时将考虑VRBPAC的建议。除了已被纳入世界卫生组织紧急使用名单外,Novavax新冠疫苗已获得40多个国家的授权,批准将其用于18岁及以上的个人。
关于NVX-CoV2373
NVX-CoV2373是一种基于蛋白质的疫苗,根据SARS-CoV-2(新冠肺炎致病病毒)首个毒株的基因序列改造而成。该疫苗采用Novavax重组纳米颗粒技术创造,以产生由冠状病毒刺突蛋白衍生的抗原,同时还使用Novavax获得专利的皂甙基Matrix-M™佐剂配制,以增强免疫应答和刺激产生高水平的中和抗体。NVX-CoV2373含有纯化蛋白抗原,不会复制,也不会导致新冠肺炎。
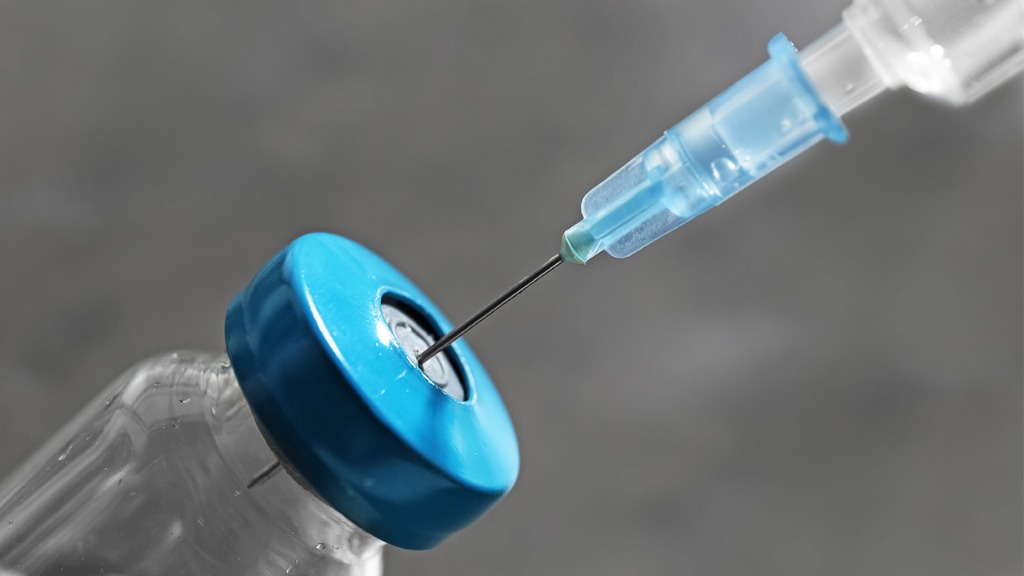
Novavax新冠疫苗以即用型液体制剂的方式封装在十剂量药瓶中。疫苗接种方案要求分两次进行肌肉注射,间隔21天,每次0.5毫升(5微克抗原和50微克Matrix-M佐剂)。这款疫苗的储存温度为2-8摄氏度之间,可使用现有疫苗供应和冷链渠道。疫苗的使用应遵照官方建议。
Novavax已在全球范围内建立了NVX-CoV2373的生产、商业化和分销合作伙伴关系。现有授权利用Novavax与印度血清研究所的制造合作伙伴关系,该研究所是世界上产量最大的疫苗制造商。随后,Novavax整个全球供应链中其他制造工厂的数据将为此提供补充。
更多健康资讯请点击医药头条,为您带来更多精彩内容!










2024-04-19
2024-04-19
2024-04-19
2024-04-19

2024-04-19

2024-04-19
2024-04-19

2024-04-19

2024-04-19

2024-04-19