CAR-T疗法已经在治疗血液癌症方面表现出惊人的疗效,首位接受CAR-T治疗的儿童患者EmilyWhitehead已经10年无癌。它让血液癌症患者看到了治愈的希望。然而,对很多患者来说,癌症仍然会卷土重来。近日,哈佛大学和斯坦福大学的两支研究团队在《自然-医学》杂志上发表文章,各自独立揭示了在CAR-T疗法制造过程中混入的调节性T细胞可能是导致CAR-T疗法效果不佳的原因之一。这一发现有望进一步改良CAR-T疗法的制造方式,提高未来疗法的疗效。

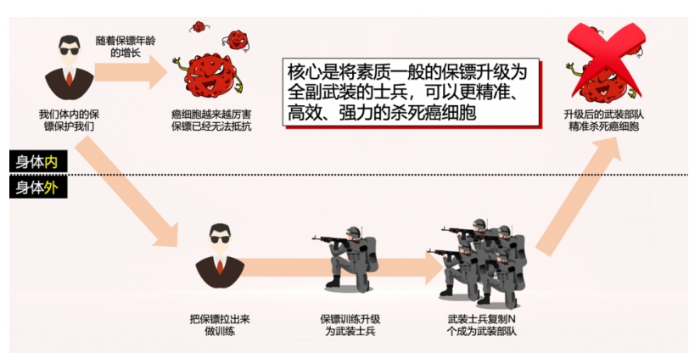
CAR-T疗法的制造过程需要从患者体内获取T细胞,在体外进行基因工程改造,将靶向肿瘤抗原的嵌合抗原受体(CAR)表达在T细胞的表面,这些CAR会引导T细胞来到表达抗原的肿瘤细胞附近,并且激活T细胞杀伤肿瘤细胞。
从患者体内获取的T细胞包含很多类型,比如CD8阳性的细胞毒性T细胞,以及CD4阳性的辅助T细胞。研究人员对获得缓解的癌症患者和癌症复发的患者体内的CAR-T细胞类型进行了比较,希望从中找到耐药性产生的线索。
使用单细胞RNA测序等技术,两支研究团队分别对接受CAR-T疗法治疗之后,患者体内CAR-T细胞的类型进行了评估。令人意外的是,他们都发现,CAR-T细胞中存在着一小部分调节性T细胞(Treg)。这引起了研究人员的注意。
调节性T细胞在免疫系统中具有和效应T细胞相反的功能,通常效应T细胞被抗原呈递细胞(APC)呈递的抗原激活之后,会分化成细胞毒性T细胞,这些细胞在识别靶细胞表面的抗原后会行使细胞毒性功能,摧毁靶细胞。
调节性T细胞细胞被激活之后,可以通过多种手段来抑制周围的效应T细胞。包括表达抗炎症的细胞因子,例如IL-10,TGFβ和IL-35;以及消耗激活效应T细胞的细胞因子IL-2。它们还可以通过与APC的相互作用,间接抑制效应T细胞的激活。调节性T细胞免疫抑制能力的一个重要特征是称为“旁观者抑制”(bystandersuppression)的现象。它指的是,虽然调节性T细胞被一个特定的抗原激活,但是激活以后,它可以抑制靶向其它抗原的效应T细胞的活性。这些特征让调节性T细胞成为

治疗自身免疫性疾病和炎症性疾病
的理想工具。
然而在CAR-T疗法中发现调节性T细胞却并不是什么好事,这些调节性T细胞可能同样被肿瘤表达的抗原激活,从而抑制周围的细胞毒性CAR-T细胞的活性,降低CAR-T疗法的疗效。
哈佛大学团队都发现,患者是否产生应答和CAR-T细胞疗法中的调节性T细胞成分相关。“在应答患者中,调节性T细胞的比例平均为2%,而在无应答者中,这一比例提高的5~6%。”哈佛大学研究的第一作者,哈佛大学生物物理学系的博士生NicholasJ.Haradhvala说。
为了验证调节性T细胞是否会降低CAR-T疗法的效果,研究人员在小鼠模型中检验了将携带CAR的调节性T细胞(CAR-Treg)混入到CAR-T细胞疗法中的结果。他们发现,CAR-Treg的比例如果达到CAR-T细胞疗法的5%,就能显著提高肿瘤在小鼠体内的增殖,而混入非CAR-Treg的其它CD4阳性T细胞则不会有这个影响。
▲在CAR-T细胞疗法中加入CAR-Treg显著降低治疗效果(图片来源:参考资料[2])
在斯坦福大学团队的研究中,研究人员同样发现CAR-Treg细胞的比例与癌症进展和CAR-T细胞疗法的神经毒性相关。CAR-Treg细胞的比例越高,疾病进展的风险也越高,同时神经毒性症状也越轻。
更多健康资讯请点击医药头条,为您带来更多精彩内容!







2024-10-12
2024-10-12

2024-10-12
2024-10-12

2024-10-12

2024-10-12

2024-10-12

2024-10-12

2024-10-12

2024-10-12